
1. Born-Oppenheimer-Näherung:


H = Te + TK + Vee + VeK + VKK
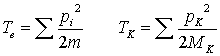

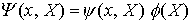
x = Elektronenkoordinaten
X = Kernkoordinaten

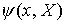 die Schrödinger-Gleichung
die Schrödinger-Gleichung 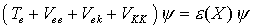
mit
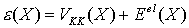
Die Kernlagen X sind Parameter

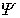 in die gesamte Schrödinger-Gleichung
in die gesamte Schrödinger-Gleichung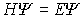 mit Benutzung der Schrödinger-Gleichung für
mit Benutzung der Schrödinger-Gleichung für 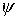 und Vernachlässigung von Termen (Born-Oppenheimer-Näherung) folgt die Born-Oppenheimer-Gleichung:
und Vernachlässigung von Termen (Born-Oppenheimer-Näherung) folgt die Born-Oppenheimer-Gleichung: 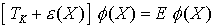
Aus
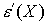 = 0 folgt die Gleichgewichtslage der Kerne
= 0 folgt die Gleichgewichtslage der Kerne 
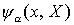 folgt mit Entwicklung von
folgt mit Entwicklung von 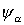 :
: 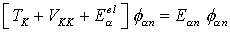 (Born-Oppenheimer-Gleichung)
(Born-Oppenheimer-Gleichung) 

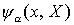 und elektronischen Energien
und elektronischen Energien 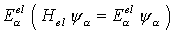 lässt sich aus der Born-Oppenheimer-Gleichung die Gesamtwellenfunktion
lässt sich aus der Born-Oppenheimer-Gleichung die Gesamtwellenfunktion 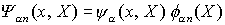 bestimmen
bestimmen 
Quantenmechanik: Bornsche Näherung in der Streutheorie Beispiel: Bornsche Näherung im rotationssymmetrischen Potential
Link zum Thema Eintragen - Beitrag zum Thema Schreiben - Persönliche Anmerkung - Diskussionsbeitrag zum Thema
 - mehr Bücher im
- mehr Bücher im