
4. Energie des Wasserstoffmoleküls:

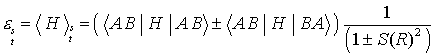

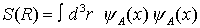

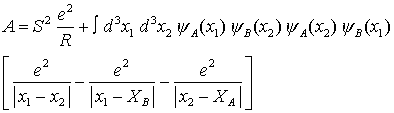
ist ein Effekt von Pauli Prinzip + Coulomb Wechselwirkung
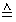 Überlappung der Wellenfunktionen gewichtet mit Epot
Überlappung der Wellenfunktionen gewichtet mit Epot 
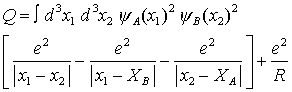

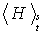 (Schwabl)
(Schwabl) ergibt sich
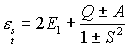
E1 ist die Energie des H Atoms


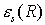 , liefert aber nur einen qualitativ richtigen Wert
, liefert aber nur einen qualitativ richtigen Wert 
Experimentalphysik 1-4: Potentielle Energie Kinetische Energie Energie des harmonischen Oszillators Innere Energie Innere Energie von Gasen Energie des elektrischen Feldes Energie im Magnetfeld
Quantenmechanik: Energie - Zeit Unschärfe
Schulphysik: Energie Potentielle Energie und Potential Energie des harmonischen Oszillators Energie des elektrischen Feldes
Link zum Thema Eintragen - Beitrag zum Thema Schreiben - Persönliche Anmerkung - Diskussionsbeitrag zum Thema

 - mehr Bücher im
- mehr Bücher im