
8. Energieeigenwerte des Wasserstoffatoms:


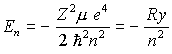 (CGS Ladungseinheit:
(CGS Ladungseinheit: 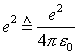 )
) n = N + l + 1; n = 1, 2, 3, ...
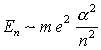

Entartungsgrad =
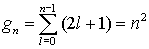


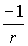 Potentials, kann begründet werden mit der Existenz einer speziellen Erhaltungsgröße: Lenzscher Vektor
Potentials, kann begründet werden mit der Existenz einer speziellen Erhaltungsgröße: Lenzscher Vektor 
Quantenmechanik: Energieeigenwerte des harmonischen Oszillators Bestimmung der Energieeigenwerte beim eindimensionalen Potentialtopf Normierte Wellenfunktionen des Wasserstoffatoms Radiale Wellenfunktionen des Wasserstoffatoms Quantenzahlen des Wasserstoffatoms Dirac-Gleichung des Wasserstoffatoms
Link zum Thema Eintragen - Beitrag zum Thema Schreiben - Persönliche Anmerkung - Diskussionsbeitrag zum Thema
 - mehr Bücher im
- mehr Bücher im